Pozytywne wyniki badań Celon Pharma w leczeniu powikłań w chorobie Parkinsona istotnie wzmacniają i podnoszą wartość całego programu CPL'36 oraz samego leku, mówi Maciej Wieczorek
Celon Pharma opublikowała pozytywne wyniki badań II fazy dla swojej cząsteczki CPL'36, czyli inhibitora PDE10A w leczeniu dyskinez polewodopowych w chorobie Parkinsona. To drugi pozytywny odczyt badań dla tej cząsteczki, po wskazaniu związanym ze schizofrenią. CEO spółki, Maciej Wieczorek, ocenia, że nowe dane tylko wzmacniają wartość całego programu i nakreśla możliwe scenariusze komercjalizacji.
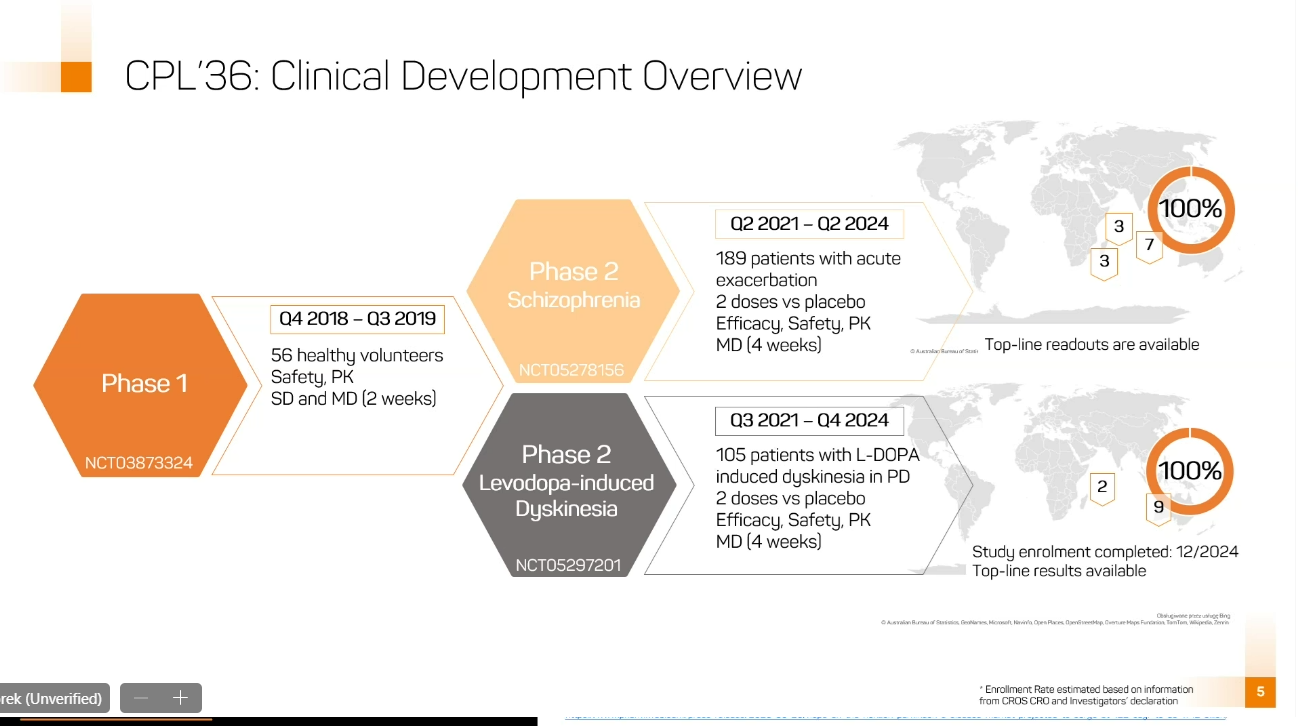
Badanie II fazy klinicznej CPL'36 było międzynarodowym, wieloośrodkowym, randomizowanym i kontrolowanym placebo badaniem, w którym wzięło udział 105 dorosłych pacjentów z dyskinezami w chorobie Parkinsona. CPL'36 był podawany przez cztery tygodnie w dwóch dawkach (20 mg i 40 mg raz dziennie) lub placebo w stosunku 1:1:1. Pacjenci mieli umiarkowanie ciężkie do ciężkich dyskinezy na początku badania, z wynikiem około 45 jednostek w skali UDysRS Total.
REKLAMA
Wyniki badania są istotne – podkreśla Celon Pharma – ponieważ jest to pierwsze badanie kliniczne, które wykazało, że inhibicja PDE10A przy pomocy CPL'36 wywołuje pozytywne, istotne statystycznie i klinicznie efekty w zakresie pierwszo- i drugorzędowych punktów końcowych u pacjentów z dyskinezami w chorobie Parkinsona. Spółka ocenia, że wyniki te będą miały istotne znaczenie dla rozwoju rynku farmakoterapii choroby Parkinsona.
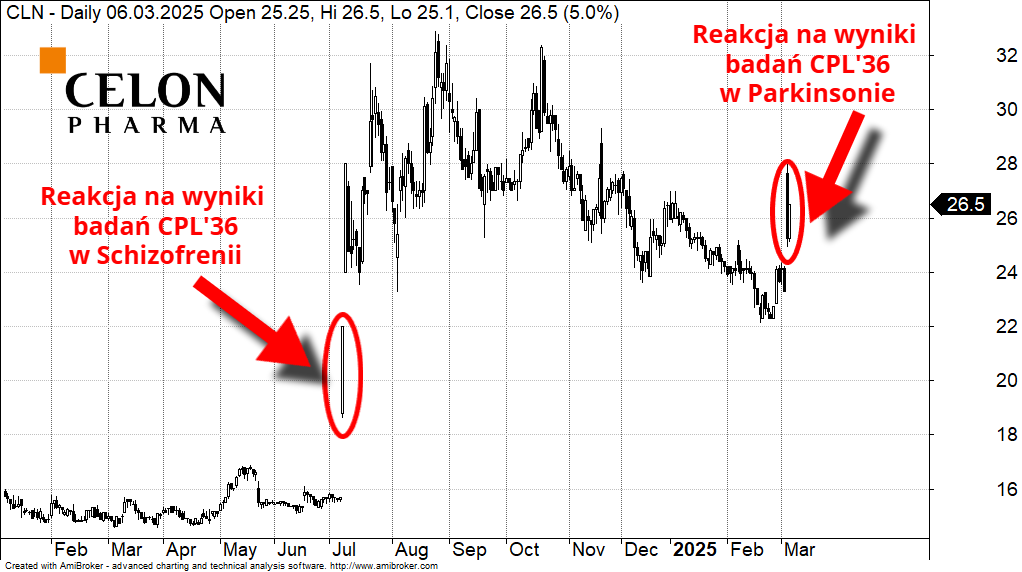
Celon Pharma w górę o 40%. CEO widzi ogromny potencjał kandydata na lek na schizofrenię
Drugie pozytywne wyniki badań II fazy
To drugie pozytywne wyniki badań dla CPL'36 w II fazie. Na początku lipca 2024 r. Celon Pharma opublikowała pozytywne wyniki badań dla cząsteczki we wskazaniu związanym ze schizofrenią.
źródło: prezentacja Celon Pharma
W sumie do tej pory cząsteczkę CPL'36 w II fazie klinicznej otrzymało niemal 300 pacjentów. Prezes Celon Pharmy podkreśla unikatowoś cząsteczki, która ma wyjątkowy profil farmakodynamiczny i dobry profil bezpieczeństwa, wolny od działań metabolicznych. W połączeniu z wykazaną efektywnością czyni to CPL'36 potencjalnie przełomowym lekiem w leczeniu dyskinez w chorobie Parkinsona, stanowiącym atrakcyjną alternatywę dla obecnie stosowanej amantadyny, zwłaszcza ze względu na korzystniejszy profil bezpieczeństwa.
Wieczorek porównał wyniki CPL'36 z amantadyną ER (o przedłużonym uwalnianiu), jedynym zatwierdzonym lekiem na dyskinezy w chorobie Parkinsona. W trakcie prezentacji stwierdził, że efektywność CPL'36 jest co najmniej porównywalna z amantadyną ER, wskazując na blisko 14 jednostek redukcji w skali UDysRS w badaniu CPL'36 versus 10 jednostek w przypadku amantadyny ER.
Kurs akcji Celon Pharma od początku 2024 roku
Kluczową różnicą, na którą zwrócił uwagę prezes Celon Pharma, jest profil bezpieczeństwa. W badaniach III fazy amantadyny obserwowano częste występowanie halucynacji (około 20-30% pacjentów) oraz działań cholinolitycznych (suchość w ustach, zatwardzenia), które często prowadziły do przerwania leczenia. Natomiast CPL'36 w dotychczasowych badaniach wykazał znacząco korzystniejszy profil działań niepożądanych, z dominującą sennością o nasileniu łagodnym do umiarkowanego, która była lepiej tolerowana przez pacjentów.
Możliwe scenariusze komercjalizacji CPL'36
Rozmowy na temat potencjalnej komercjalizacji CPL'36 trwają już od publikacji wyników II fazy klinicznej dla cząsteczki. Obie wskazania CPL'36 celują w duże rynki. Według danych przedstawionych przez Celon Pharmę szacowana wartość rynku związanego ze schizofrenią wynosi 8,1 mld USD, a dla LiD 5,4 mld USD i oba rosną.
źródło: prezentacja Celon Pharma
Maciej Wieczorek nie chciał podawać konkretnych dat finalizacji umów, ale stwierdził, że rozmowy z potencjalnymi partnerami są bardzo zaawansowane, a co najmniej dwie firmy są w nie aktywnie zaangażowane. Na ten moment trendy rynkowe wskazują, że najbardziej prawdopodobny jest scenariusz komercjalizacji ze znacznym upfront payment, a Celon Pharma, jako licencjodawca, może oczekiwać kilkunastu do 20% od wartości sprzedaży netto leku po jego wprowadzeniu na rynek.
W tym momencie nie są prowadzone prace nad emisją akcji, ale spółka rozważa wejście na NASDAQ w perspektywie średnioterminowej, co jest częścią strategii mającej na celu zwiększenie wartości spółki i dopasowanie profilu ryzyka inwestycyjnego do oczekiwań inwestorów, zwłaszcza amerykańskich, którzy preferują czyste inwestycje w innowacje. Decyzja nie jest przesądzona, ale spółka podejmuje kroki przygotowawcze w tym kierunku, co w praktyce może docelowo oznaczać rozdzielenie części innowacyjnej i generycznej Celon Pharmy w przyszłości.