Akcje Biogen wzrosły już 60% od zatwierdzenia leku na Alzheimera przez FDA
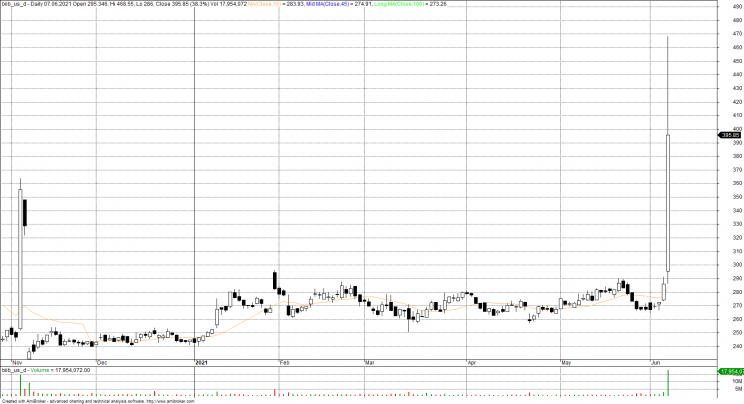
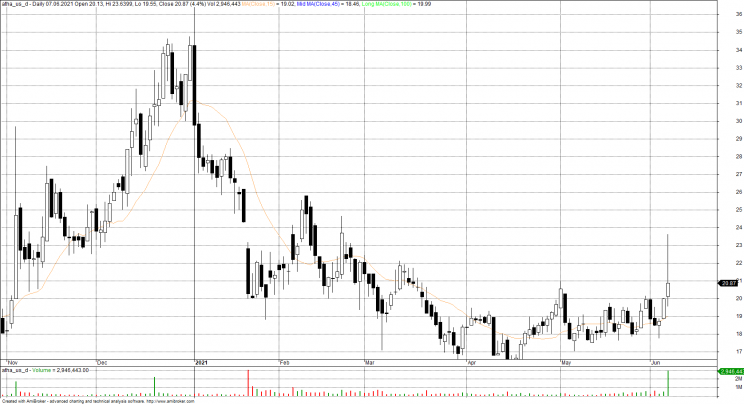
Amerykańska Agencja ds. Żywności i Leków (Food and Drug Administration) zatwierdziła w poniedziałek terapię dla chorych dla Alzheimera aducanumab firmy Biogen. Nowy lek to ważne wydarzenie dla chorych, ale też inwestorów, bo akcje biotechnologicznej Biogen wzrosły o prawie 60% po wznowieniu notowań.
Zobacz także: Lek na chorobę Alzheimera firmy Biogen zatwierdzony przez FDA. Rosną akcje spółki
Nowy lek na Alzheimera z ceną zgodną z oczekiwaniami analityków
Biogen ogłosił, że aducanumabu będzie kosztował 56 000 USD rocznie za dawkę podtrzymującą, choć koszt w pierwszym roku będzie niższy. Cena zgodna z oczekiwaniami analityków. Jest to znacznie powyżej ceny, którą Instytut Badań Klinicznych i Ekonomicznych (Institute for Clinical and Economic Review). ,,Jeśli zastosujemy mieszane wyniki skuteczności z badań fazy III, nasze analizy bazowe sugerują, że roczny koszt 50 000 USD za aducanumab... nie byłby zgodny z korzyściami klinicznymi" - stwierdziła grupa w raporcie okresowym. Zaproponowano ceny pomiędzy 2 560 a 8 290 USD rocznie.
REKLAMA
Lek będzie sprzedawany pod nazwą Aduhelm. Decyzja ta jest historycznym krokiem w leczeniu Alzheimera. FDA nie zatwierdziła żadnej nowej terapii Alzheimera od 2003 roku. Od tego czasu liczba zgonów w USA przypisywanych chorobie Alzheimera w skali roku wzrosła prawie dwukrotnie. Na chorobę tę choruje obecnie ponad sześć milionów Amerykanów.
Co więcej, aducanumab jest pierwszym lekiem zatwierdzonym ze względu na jego widoczną zdolność do zmiany przebiegu choroby, a nie leczenia jej objawów. Grupy wsparcia dla pacjentów z chorobą Alzheimera dążyły do zatwierdzenia leku, nawet pomimo sceptycyzmu niektórych ekspertów.
Lek na Alzheimera – co na to Wall Street?
FDA przyznała zatwierdzenie w ramach swojego przyspieszonego programu wydawania decyzji, dzięki któremu może dopuszczać leki na poważne choroby w oparciu o dane, które zdaniem agencji sugerują, że jest prawdopodobne, aby przewidzieć korzyści kliniczne.
W oświadczeniu agencja tłumaczy, iż zdecydowała się dać lek przyspieszonej akceptacji po stwierdzeniu, że korzyści z leku przewyższają ryzyko. Co więcej, agencja ustanowiła również precedens zatwierdzania leków na Alzheimera w oparciu o ich zdolność do usuwania blaszek beta amyloidu, które uważane są za odgrywające rolę w chorobie.
The Institute for Clinical and Economic Review, wpływowy głos w sprawie cen leków, powiedział w projekcie raportu na początku maja, że nie ma wystarczających dowodów, aby wiedzieć, czy korzyści aducanumabu przewyższają jego szkody, a nawet czy zmniejsza on postęp choroby Alzheimera.
W oddzielnym liście do komitetu doradczego, który odradzał zatwierdzeniu leku, dyrektor biura neurobiologii FDA, dr Billy Dunn, napisał, że uważnie wysłuchał obaw komitetu.
,,Ostatecznie decyzja o tym, czy aducanumab będzie stosowany w leczeniu, zostanie podjęta przez pacjentów, ich rodziny i opiekunów oraz pracowników służby zdrowia" - napisał Dunn. ,,Opinia publiczna może być pewna, że agencja zastosowała rygorystyczne, oparte na naukowych dowodach podejście do oceny tej terapii, biorąc pod uwagę wszystkie dowody zawarte we wniosku, a także ogromną, niezaspokojoną potrzebę medyczną dla wielu pacjentów żyjących z tą chorobą".
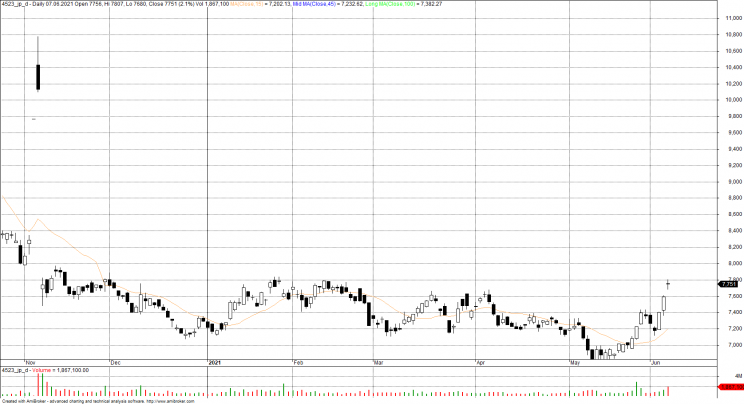
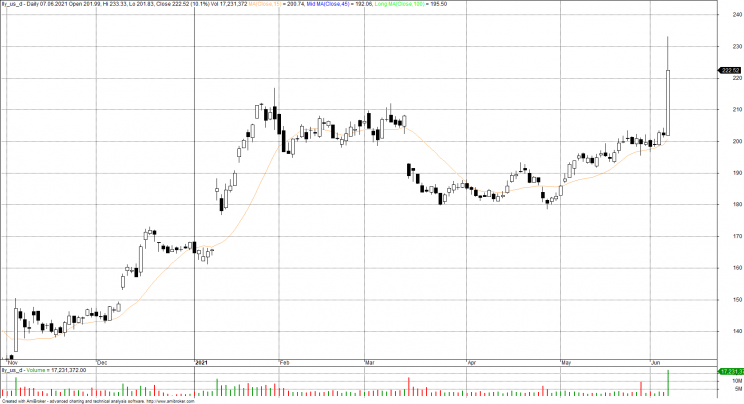
Decyzja agencji rozpaliła wszystkich producentów leków. Nie tylko akcje Biogenu poszybowały w kosmos. Oprócz tego akcje Eisai wzrosły o 53%, a akcje Eli Lilly, który pracuje nad podobnym lekiem, wzrosły o 10%. Fundusz iShares Nasdaq Biotechnology Exchange Traded Fund, który śledzi sektor biotechnologiczny, wzrósł o 4,5%
Biogen
Eisai
Eli Lilly
Zobacz także: Bill Ackman kupił duży pakiet akcji Domino’s Pizza, a jego SPAC chce objąć 10% w Universal Music
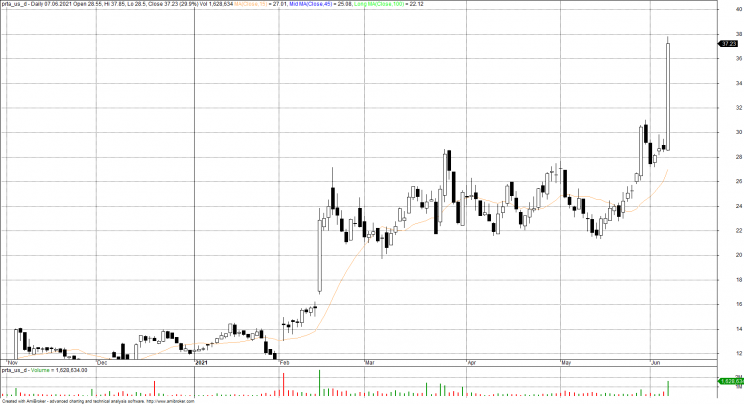
Wzrosły również akcje mniejszych firm pracujących nad leczeniem choroby Alzheimera. Akcje Prothena podskoczyły o 15,2%, podczas gdy akcje Denali Therapeutics wzrosły o 8,4%, a Athira Pharma o 14,2%.
Jest to długo oczekiwana dobra wiadomość dla Biogen i dla branży Alzheimera, biorąc pod uwagę znaczące niezaspokojone potrzeby" - napisał w poniedziałek Marc Goodman, analityk SVB Leerink.
Analityk Citigroup Mohit Bansal, w osobnej nocie, napisał, że decyzja była zaskakująca. ,,Potrzeba wygrywa z nauką, ponieważ FDA znajduje sposób na zatwierdzenie leku" - napisał Bansal. ,,Wydaje się, że agencja zajęła stanowisko, aby zatwierdzić na biomarker redukcji blaszki amyloidowej, a nie funkcjonalny punkt końcowy".
Prothena
Denali Therapeutics
Athira Pharma
Agencja wymaga, aby Biogen przeprowadził badanie potwierdzające
Analityk Piper Sandler Christopher Raymond, który argumentował przeciwko zatwierdzeniu leku przez FDA, powiedział, że agencja rzuciła "ostrożność (i rygor naukowy) na wiatr."
Analityk Jefferies Michael Yee, który był bardziej pewny niż większość, że agencja zatwierdzi lek, powiedział, że inwestorzy prawdopodobnie nie będą się martwić o wymagane dodatkowe badania. Wprowadzenie leku na rynek będzie teraz przedmiotem debaty inwestorów, zauważył. Istnieją kwestie logistyczne i istotne pytania dotyczące cen.
"To jest nowy dzień," powiedział Harry Johns, prezes i dyrektor generalny Stowarzyszenia Alzheimera, który opowiedział się za zatwierdzeniem leku. "Ta zgoda pozwala ludziom żyjącym z Alzheimerem więcej czasu, aby żyć lepiej".
Lek, jednak, nie jest lekarstwem. Dr Samuel Gandy, profesor na Mount Sinai i dyrektor Mount Sinai's Center of Cognitive Health, powiedział, że klinicyści będą musieli zarządzać oczekiwaniami pacjentów i rodzin. Lek ma za zadanie spowolnić postęp choroby, a nie ją cofnąć.
,,Leczenie lekiem Aduhelm zostało wyraźnie wykazane we wszystkich badaniach w celu znacznego zmniejszenia blaszek amyloidu beta," szef agencji centrum oceny i badań leków, dr Patrizia Cavazzoni, napisał w liście wyjaśniającym decyzję. ,,Ta redukcja blaszek jest z dużym prawdopodobieństwem skutkiem korzyści klinicznych".
Zobacz także: Ekonomiści Goldman Sachs prognozują, że w maju inflacja w Polsce osiągnęła szczyt i do końca roku będzie spadać