Lek na chorobę Alzheimera firmy Biogen zatwierdzony przez FDA. Rosną akcje spółki
Amerykańska Agencja ds. Żywności i Leków poinformowała w poniedziałek, że zatwierdziła terapię na Alzheimera lekiem aducanumab firmy Biogen. Decyzja ta będzie miała ogromny wpływ na pacjentów, akcje biotechnologiczne i farmaceutyczne oraz cały obszar rozwoju leków. FDA przyznała zatwierdzenie w ramach swojego przyspieszonego programu zatwierdzania, dzięki któremu może zatwierdzać leki na poważne choroby w oparciu o dane, które zdaniem agencji sugerują, że jest prawdopodobne, aby przewidzieć korzyści kliniczne. Akcje Biogenu zyskały już 5% w zeszłym tygodniu.
REKLAMA
Zobacz także: Akcjonariusze Biogen wytrzymują oddech. Pierwszy od 20 lat nowy lek na Alzhaimera może zostać zatwierdzony przez FDA w poniedziałek
Lek Biogenu dostaje zielone światło od FDA
W oświadczeniu wyjaśniającym swoją decyzję, agencja powiedziała, że zdecydowała się dać lek przyspieszonej akceptacji po stwierdzeniu, że korzyści z leku przewyższają ryzyko. Dyrektor biura neurobiologii FDA, dr Billy Dunn, napisał, że uważnie wysłuchał obaw komitetu.
,,Ostatecznie decyzja o tym, czy aducanumab będzie stosowany w leczeniu, zostanie podjęta przez pacjentów, ich rodziny i opiekunów oraz pracowników służby zdrowia" - napisał Dunn. ,,Opinia publiczna może być pewna, że agencja użyła rygorystycznego, opartego na nauce podejścia do oceny tej terapii, biorąc pod uwagę wszystkie dowody we wniosku, a także dobro medyczne wielu pacjentów żyjących z tą chorobą".
Zatwierdzenie jest prawie bez precedensu i dzieli ekspertów naukowych. Komitet doradczy FDA stwierdził w listopadzie, że Biogen nie zgromadził dowodów na poparcie skuteczności leku. Pracownicy FDA rzadko ignorują rady komitetów doradczych agencji.
Mimo to, decyzja jest historycznym krokiem w leczeniu choroby Alzheimera. FDA nie zatwierdziła żadnej nowej terapii Alzheimera od 2003 roku. Od tego czasu liczba zgonów w USA przypisywanych chorobie Alzheimera w skali roku wzrosła prawie dwukrotnie. Na chorobę tę choruje obecnie ponad sześć milionów Amerykanów.
Co więcej, aducanumab jest pierwszym lekiem zatwierdzonym ze względu na jego widoczną zdolność do zmiany przebiegu choroby, a nie leczenia jej objawów. Grupy wsparcia dla pacjentów z chorobą Alzheimera dążyły do zatwierdzenia leku, nawet pomimo sceptycyzmu niektórych ekspertów.
Pozostają jednak pytania, czy ubezpieczyciele oraz lekarze będą skłonni ryzykować, aby zlecać leczenie, biorąc pod uwagę pytania dotyczące jego skuteczności. The Institute for Clinical and Economic Review, wpływowy głos w sprawie cen leków, powiedział w projekcie raportu na początku maja, że nie ma wystarczających dowodów, aby wiedzieć, czy korzyści aducanumabu przeważają nad skutkami ubocznymi, a nawet czy zmniejsza on postęp choroby Alzheimera.
Zobacz także: Fundusze inwestycyjne unikają akcji meme stocks, jak GameStop, bo traktują je jako przejściową modę
Prognozy analityków dotyczące sprzedaży leku spadają. Konsensus analityków FactSet dotyczący sprzedaży aducanumabu w 2023 roku wynosi obecnie 1,6 mld USD, co oznacza spadek z poziomu 2 mld USD pod koniec marca.
Akcje Biogen w tygodniu poprzedzającym wydanie decyzji wzrosły o 6%. Analitycy przewidują, że dopiero efekty drugiego rzędu, czyli to jak decyzja wpłynie na zyski spółki będzie odbijać się jeszcze tygodniami na rynkach biotechnologicznych i farmaceutycznych. Teraz debata będzie toczyła się wokół cen leków oraz akcji. Spółka napotyka opór ze strony lekarze, którzy sceptycznie podchodzą do leku.
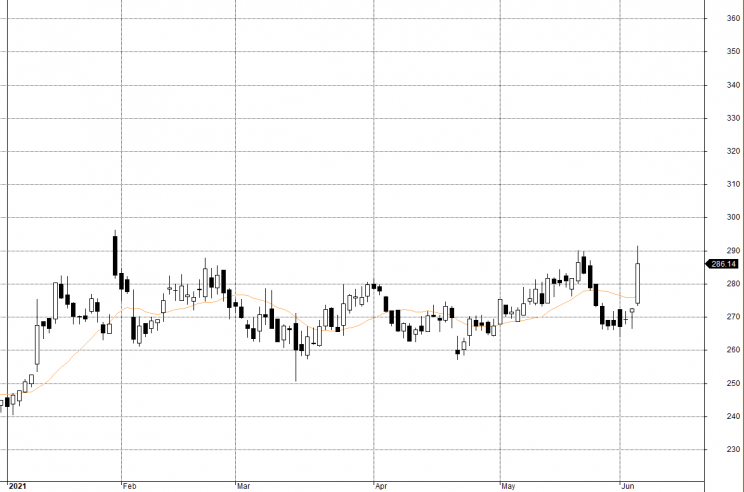
Notowania BIOGEN
ICER obliczył ceny między 2 560 a 8 290 USD rocznie dla aducanumabu na podstawie efektywności kosztowej, w porównaniu z ceną 50 000 USD rocznie, oczekiwaną przez analityków.
New York Times opublikował opinie profesorów ostrzegających przed zatwierdzeniem aducanumabu. Dr Jason Karlawish, profesor na University of Pennsylvania School of Medicine i współdyrektor Penn Memory Center, powiedział, że nie będzie przepisywał aducanumabu, jeśli zostanie on zatwierdzony.
Decyzja ta będzie miała daleko idące konsekwencje dla rozwoju leków na chorobę Alzheimera. Firma Eli Lilly opracowuje inną terapię choroby Alzheimera, która działa na podobnych zasadach jak aducanumab, zwaną donanemabem. W marcu firma Lilly opublikowała dane z niewielkiego badania nad donanemabem. Dane rozczarowały inwestorów.
Kontrowersje dookoła leku spółki Biogen
W 2019 roku, Biogen ogłosił, że przerywa dwa badania w ostatniej fazie aducanumabu po tym, jak niezależna komisja monitorująca dane stwierdziła, że jest mało prawdopodobne, aby badania zakończyły się sukcesem. Akcje Biogen spadły o 29% w ciągu jednego dnia. Kilka miesięcy później firma ogłosiła, że nowa analiza przywraca rozmowy z FDA.
Ta wiadomość, która pojawiła się w październiku 2019 r., doprowadziła akcje Biogen do skoku o 26% w ciągu jednego dnia, aby zamknąć się na poziomie 281,87 USD.
W listopadzie 2020 roku, komitet doradczy FDA powiedział, że dowody na aducanumab nie udowadniają skuteczności. Akcje wzrosły o 44%, gdy FDA opublikowała swoje dokumenty informacyjne przed tym spotkaniem, a następnie spadły o 28,2% po głosowaniu komisji.
,,Tam była specjalna relacja między spółką, a agencją. Można to było wyraźnie dostrzec. Dokumenty informacyjne były bezprecedensowe. Wykonuję tę pracę od ponad 20 lat i rozmawiałem z ludźmi, którzy robią to dłużej, i nigdy tak naprawdę nie widzieliśmy czegoś takiego wcześniej, gdzie FDA po prostu pracuje tak blisko z firmą. Poszli do [komitetu doradczego] w zasadzie mówiąc, 'Ten lek zostanie zatwierdzony.'", skomentował Marc Goodman, analityk z SVB Leerink początkiem roku.
Dlatego też, pomimo wyjątkowo negatywnej odpowiedzi komitetu doradczego FDA, inwestorzy zachowali nadzieję.
Opiekunowie pacjentów z chorobą Alzheimera naciskali na zatwierdzenie leku. ,,Podczas gdy dane z badań doprowadziły do pewnej niepewności wśród społeczności naukowej, musi to być ważone w stosunku do pewności, co ta choroba zrobi milionom Amerykanów bez leczenia", napisał członek zarządu Stowarzyszenia Alzheimera w publicznym komentarzu przedłożonym komitetowi doradczemu FDA.
Jednak naukowcy argumentowali, że zatwierdzenie leku, który może nie działać nie jest pomocne i może zaszkodzić wysiłkom w celu znalezienia leku, który działa.