Priorytetem dla Ryvu Therapeutics jest teraz partnering. Dopiero jeśli się nie uda, rozważymy inne opcje - mówi Paweł Przewięźlikowski, CEO spółki
Ryvu Therapeutics intensyfikuje rozmowy dotyczące komercjalizacji swojego najbardziej zaawansowanego projektu RVU120, znajdującego się obecnie w drugiej fazie badań klinicznych i na ten moment nie planuje emisji akcji. Kluczowym wydarzeniem będzie grudniowa konferencja ASH, podczas której spółka zaprezentuje pełne wyniki badań RVU120 w terapii ostrej białaczki szpikowej w skojarzeniu z venetoklaksem. O aktualnej sytuacji Ryvu Therapeutics oraz kondycji całej branży biotechnologicznej rozmawiamy z jej założycielem i prezesem, Pawłem Przewięźlikowskim.
Z tej rozmowy dowiesz się:
- jak interpretować dotychczasowe wyniki badań RVU120 i które dane będą teraz kluczowe,
- co dla inwestorów oznacza rozpoczęcie niekomercyjnego badania RVU120 u dzieci z medulloblastomą,
- w jaki sposób optymalizacja kosztów i współpraca z BioNTech w obszarze badań klinicznych wpływa na cash runway Ryvu,
- jakie trendy dominują obecnie w globalnej biotechnologii i jakie mogą mieć konsekwencje dla polskiego sektora life sciences.
Paweł Biedrzycki: Zacznijmy od wyników klinicznych z drugiej fazy dla RVU120, które opublikowaliście w czerwcu. Jak oceniasz wskaźnik Complete Response w kombinacji z Venetoklaksem na poziom 26%?
Paweł Przewięźlikowski: Wyniki oceniamy dobrze. Zakładaliśmy minimalny poziom kompletnych odpowiedzi na poziomie 20%, a w niektórych grupach pacjentów osiągnęliśmy nawet poziom 30-50%. Potrzebujemy jednak jeszcze danych o czasie trwania tych odpowiedzi, co dopiero można zaobserwować w dłuższym okresie. W czerwcu pacjenci byli na leku około trzech miesięcy. Jeśli średnio będą na nim co najmniej cztery miesiące, to wynik będzie dobry, pięć miesięcy bardzo dobry, a sześć wybitny.
REKLAMA
Czyli teraz kluczowa jest długość odpowiedzi na terapię?
Tak, lato i jesień tego roku to momenty oceny, jak długo pacjenci pozostają w badaniu i jak długo działanie leku się utrzymuje. Jeśli pacjenci utrzymają się w badaniu co najmniej cztery miesiące, to mamy silne podstawy do zintensyfikowania rozmów partneringowych z kilkoma potencjalnymi partnerami.
Kiedy możemy spodziewać się publikacji tych wyników?
Na poziomie danych poufnych, wyniki z białaczek mamy praktycznie teraz, bo pacjenci z początku badania teoretycznie mogą mieć już za sobą sześć miesięcy terapii o ile dalej pozostają w leczeniu. Z potencjalnymi partnerami, na bazie umowy o poufności, możemy podzielić się tymi danymi, o ile będą dobre, w czwartym kwartale tego roku, a wyniki publicznie planujemy ogłosić na grudniowej konferencji ASH.
Co z innymi wskazaniami dla RVU120?
Dysponujemy też wynikami w mielofibrozie, w tym przypadku obejmują one przed wszystkim redukcję wielkości śledziony, która często w tej chorobie rośnie kilkukrotnie ze względu na przejęcie procesu tworzenia krwinek z uszkodzonego szpiku kostnego. Według naszych doradców już 10% redukcja wielkości śledziony jest istotna klinicznie, a idealnie byłoby gdyby zmniejszały się o min. 35%. Analizujemy też poprawę symptomów mierzonych przez Total Symptom Score, które obejmują min. subiektywne poczucie przez pacjentów opuchlizny brzucha, bólu kości, nocnych potów i świądu. W wynikach zaprezentowanych w czerwcu widzieliśmy u niektórych pacjentów znaczącą poprawę. Dla wszystkich pacjentów mamy już dane z 12 tygodni leczenia, dla większości z 24 tygodni, bo ostatniemu pacjentowi zaczęliśmy podawać RVU120 w maju. Spływają też pierwsze wyniki po 36 tygodniach leczenia. Na początku listopada mogą również zostać udostępnione potencjalnym partnerom. Wyniki w mielofibrozie to ważny element dla przyszłości RVU120, bo mogą pokazać zastosowanie leku także poza ostrą białaczką szpikową.
Kiedy będziecie dysponować wystarczającym pakietem danych z prowadzonych przez was wskazań dla komercjalizacji?
Przy założeniu, że dane byłyby dobre, to intensyfikację rozmów partneringowych moglibyśmy założyć już w październiku-listopadzie, a grudzień to moment kluczowy ze względu na dużą konferencję ASH, gdzie pokażemy wyniki i poznamy opinie szerszego rynku.
Trochę zaskoczyliście wszystkich nowym badaniem MEDWAY, który dotyczy kombinacji RVU120 z ewerolimusem u dzieci z meduloblastomą?
To pomysł profesora Rajeeva Vibhakara z University od Colorado, który testował różne związki na komórkach medulloblastomy i odkrył dużą skuteczność RVU120 w tym wskazaniu jako efektywnego inhibitora CDK8/19. Na bazie tych wyników Pani Profesor Bożenna Dembowska-Bagińska z Centrum Zdrowia Dziecka opracowała plan badania klinicznego w Polsce i otrzymała grant z Agencji Badań Medycznych w wysokości 40 mln zł. Równolegle planowane jest badanie w USA. Należy pamiętać, że są to badania niekomercyjne – wyników nie będziemy mogli wykorzystać w procedurze rejestracyjnej. Ale poza tym, że każde uruchomione badanie wspiera rynkową wartość cząsteczki, ma ono duże znaczenie społeczne i motywacyjne - średni wiek diagnozy naszych przyszłych pacjentów to trzy lata. Trzeba jednak pamiętać, że wyniki są odległe czasowo, a sam rynek jest mały – dlatego taki projekt właśnie zasługiwał na niekomercyjne zaangażowanie ABM.
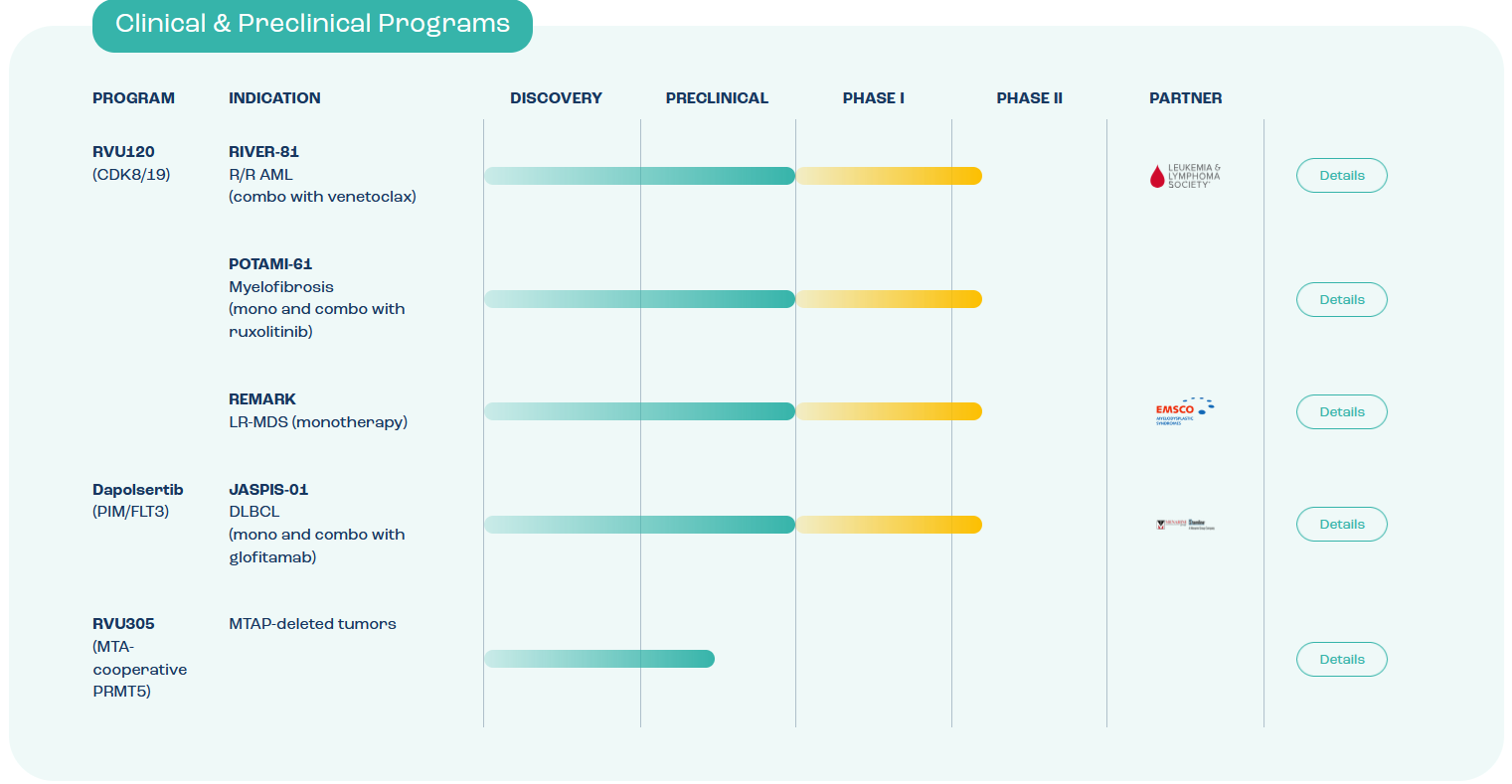
Pipeline projektów klinicznych i przedklinicznych Ryvu Therapeutics
Co z punktu widzenia akcjonariuszy Ryvu Therapeutics jest kluczowe w tym badaniu?
Myślę, że to, że wskazanie badania MEDWAY to guzy lite. Niezależny naukowiec widzi potencjał dla RVU120 w tym obszarze. Warto przypomnieć, że kiedy niemal dwa lata temu zaktualizowaliśmy strategię kliniczną RVU120, dysponując ograniczonymi zasobami zdecydowaliśmy się w tym momencie zdepriorytetyzować guzy lite na rzecz hematologii, co spotkało się z dość nerwową reakcją rynku. MEDWAY stanowi potwierdzenie, że RVU120 ma potencjał w guzach litych i innych wskazaniach, których jeszcze nie badamy w klinice.
To już druga taka niezależna inicjatywa naukowców, dlaczego niezależni eksperci trafiają akurat na RVU120?
Naukowcy z całego świata poszukują nowych opcji leczenia tam, gdzie starymi lekami niewiele się da zrobić. Szukają więc leków o nowych mechanizmach działania. RVU120 jest projektem first-in-class, więc jesteśmy partnerem chętnie wybieranym do tego rodzaju testów. Podobnie jest z badaniem RVU120 w syndromie mielodysplastycznym niskiego ryzyka realizowanym przez Prof. Uwe Platzbeckera z Uniwersytetu w Lipsku.
Z czego wynika współpraca z BioNTech pod kątem wsparcia ich badań klinicznych w Polsce?
Bardzo się cieszymy się, że BioNTech poszerzył naszą współpracę również w tym zakresie. Dzięki projektowi RVU120 zbudowaliśmy 70-osobowy, wysoko wykwalifikowany zespół kliniczny, który może nie tylko realizować nasze badania, ale też współpracować przy innych projektach i generować dodatkowe dochody. Zgodnie z planem, RVU120 weszło w fazę, w której rekrutacja nowych pacjentów jest wolniejsza, więc zespół może mieć wolne zasoby. I w oparciu o te zasoby będziemy wspierać BioNTech.
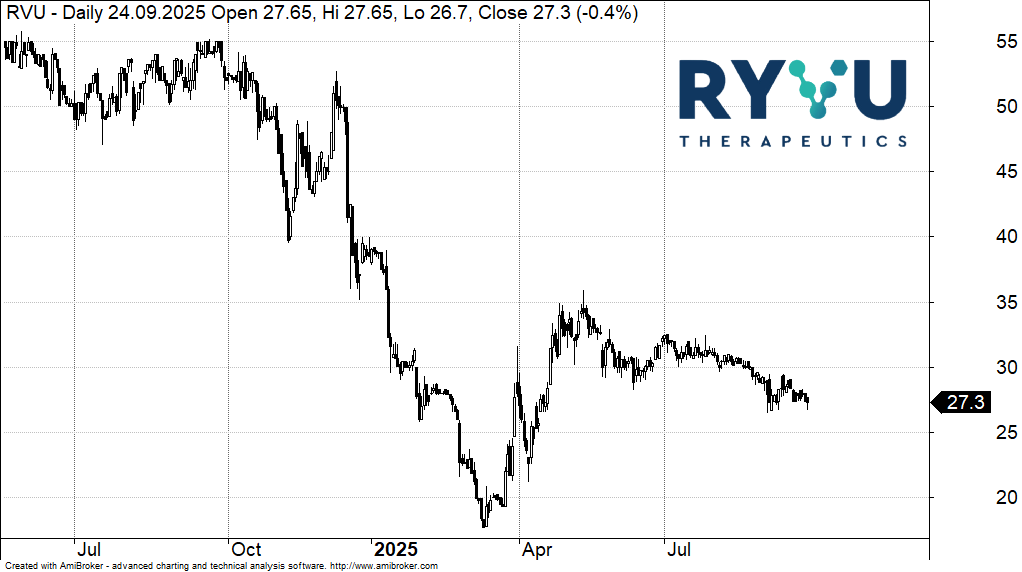
Kurs akcji Ryvu Therapeutics
Jako CEO Ryvu Therapeutics wciąż potwierdzasz, że nie interesujesz się obecnie pozyskiwaniem kapitału z rynku?
Nie, priorytetem jest dla nas partnering, choć jeśli się nie uda, rozważymy inne opcje. Nie prowadzimy żadnych działań związanych z emisją.
Jak duże są potrzeby finansowe, by przedłużyć cash runway dla Ryvu Therapeutics do 2027?
Niewiele nam do tego brakuje. W lutym zaprezentowaliśmy plan ograniczenia kosztów i ten plan skutecznie wprowadziliśmy w życie, dzięki czemu wydłużyliśmy horyzont finansowania z Q1 do H2 2026. Współpraca z BioNTech jest czymś nowym, a więc przybliża nas do 2027. Trzeba jednak pamiętać, że obecnie nie mamy środków na kolejne badania kliniczne RVU120, stąd też nacisk na poszukiwanie partnera.
Ryvu Therapeutics publikuje wyniki finansowe za I półrocze 2025 r.
Macie szanse na znaczące wpływy z partneringu tak, aby znacząco oddalić perspektywę emisji?
Mamy na to spore szanse. Naszym największym aktywem jest RVU120, cząsteczka w drugiej fazie z kompletnymi danymi klinicznymi. W tej chwili koncentrujemy się na niej i widzimy spore szanse na sukces. W najbliższym czasie będziemy aktywnie pokazywać projekt na wielu wydarzeniach. Są też współprace na wcześniejszym etapie, z których mogą pojawić się wpływy z kamieni milowych. Mamy sporo interesujących projektów w Ryvu.
Jak oceniacie sytuację na rynku biotechnologicznym, szczególnie po zmianach regulacyjnych w USA?
Od 2022 roku niestety rynek przeżywa stagnację, pogłębioną dużym spadkiem spółek po wyborach prezydenckich w USA w listopadzie ubiegłego roku. Dołek przyszedł w kwietniu 2025 w „dniu wyzwolenia” i od tego czasu w USA widzimy spore odbicie. Globalny rynek mocno się jednak zmienił i to nie jest jedynie efekt wysokich stóp procentowych. Chińczycy odpowiadają w tej chwili za aż 40% transakcji partneringowych, co wzbudza obawy amerykańskiego rządu i prowadzi do projektów ustaw, które zakładają konieczność uzyskania zgody administracji USA przez amerykańskie firmy za każdym razem, gdy te chcą zakupić chińskie aktywo. Nadal działamy w cieniu niepewności w strukturach FDA, możliwości wprowadzenie ceł na eksport leków do USA, zakazu reklamy leków w telewizji w Stanach Zjednoczonych, klauzuli most-favored-nation... Jak widać w branży jest wiele ryzyk, i inwestorzy biotechnologiczni zakładają się, czy już wszystko jest wliczone w ceny spółek i czy może już nie przyszedł czas na marsz do góry.
Dużo tego, do czego to może prowadzić?
Myślę, że koniec końców firmy zaczną szukać więcej projektów nie tylko w USA, ale też w Chinach i innych miejscach z szybszą ścieżką zatwierdzania badań i dużą populacją pacjentów. Na pewno pomogą nam też planowane restrykcje na wizy H1B – utrudnią budowanie zespołów R&D w USA i muszą oznaczać więcej zakupów technologii min. w Europie – w różnej formie poprzez zakup licencji, outsourcing, czy tworzenie nowych oddziałów amerykańskich koncernów.
To jest bez wątpienia szansa dla nas, gdzie projekty na etapie przedklinicznym i R&D można realizować dużo taniej outsourcing także stara się przyspieszyć zatwierdzanie badań klinicznych, aby zwiększyć swoją konkurencyjność. Możliwe mniejsze ceny leków w USA w przyszłości dla big pharm oznaczają, że projekty muszą być realizowane szybciej i taniej. Potrzebujemy przyspieszenia procedur, łatwiejszego dostępu do kapitału i przede wszystkim sukcesów. Myślę, że w nowej rzeczywistości dla procesu drug discovery polska biotechnologia może się odnajdywać bardzo dobrze, potrzebujemy tylko wsparcia na poziomie regulacyjnym i rządowym.