Scope Fluidics ma pełny plan jak rozbudować PCR|ONE o testy na koronawirusa i skomercjalizować urządzenie
Scope Fluidics, spółka obecna od lat na warszawskim parkiecie NewConnect, rozwija dwa projekty med-tech: PCR|ONE i BacterOMIC. Przyzwyczaiła już swoich akcjonariuszy do terminowo rozliczanych etapów działań oraz ścisłej kontroli wydatków w ramach pozyskanych środków. Spółka ogłosiła właśnie koncepcję przeprowadzenia dodatkowej emisji do 5% akcji, z planem pozyskania od 6 do 9 mln euro, jednocześnie informując (informacje podane w RB) o rozmowach z „europejską instytucją finansową”. Na co dokładnie spółka zamierza przeznaczyć środki i dlaczego to robi?
COVID-19 - wyzwanie i wielka szansa dla Scope Fluidics
PCR|ONE to system dedykowany ultra-szybkiemu wykrywaniu zakażeń. Jednak gdy Scope Fluidics pozyskiwało finansowanie na komercjalizację PCR|ONE, jeszcze w grudniu 2019 roku nikt nie spodziewał się, że dosłownie za 3 miesiące świat znajdzie się w nowej, pandemicznej rzeczywistości. Przed wybuchem epidemii wewnętrzny harmonogram spółki przewidywał komercjalizację PCR|ONE w połowie 2020 roku.
REKLAMA
„Intensywnie pracujemy nad komercjalizacją PCR|ONE. Planowaliśmy debiut rynkowy systemu już w czerwcu/lipcu bieżącego roku. Covid pokrzyżował nam plany przeprowadzenia badań klinicznych najszybszego i najbardziej informatywnego testu wykrywającego gronkowca złocistego. Wykorzystaliśmy jedną z zalet naszego systemu – uniwersalność i łatwą adaptowalność do wykrywania materiału genetycznego bakterii i wirusów – skierowaliśmy istotną energię naszego zespołu na opracowanie testu wykrywającego zakażenie wirusem SARS-CoV-2. Zmierzamy teraz do walidacji klinicznej obu paneli. Równolegle prowadzimy najważniejszy dla nas proces – znalezienia globalnego partnera – nabywcy systemu. Firmy globalne znają wartość szybkiej diagnostyki molekularnej. Dostrzegają również potrzebę potwierdzenia skuteczności działania nowego systemu, wpadki zdarzają się nawet najlepszym globalnym koncernom. Przy obecnym, gigantycznym popycie na diagnostykę molekularną point-of-care, nabywcy oczekują możliwie najkrótszego horyzontu produkcji masowej, oraz szerokiego programu testowania systemu (Early Access Program)” – tłumaczy prof. Piotr Garstecki, współzałożyciel, istotny akcjonariusz i prezes zarządu Scope Fluidics.
Pandemia COVID-19 przyspieszyła dynamiczny wzrost rynku diagnostyki molekularnej point-of-care. Jest to czynnik dodatkowej szansy na zwiększenie wartości systemu PCR|ONE. Spółka informuje, że chce wykorzystać tę szansę, poprzez m.in. przetestowanie paneli do testów SARS-SARS-CoV-2 na większej grupie pacjentów oraz przeprowadzenie nie tylko europejskiej procedury certyfikacyjnej CE-IVD, ale również przyspieszonej procedury w amerykańskiej FDA, udostępnionej specjalnie na potrzeby walki z koronawirusem. Rozszerzenie certyfikacji PCR|ONE o rynek amerykański nie było przewidywane pod koniec zeszłego roku. W wariancie początkowym urządzenie miało być bowiem przetestowane i dopuszczone tylko na rynek europejski do szybkich testów w badaniach przesiewowych, wyłącznie w kierunku MRSA.
Zobacz także: Scope Fluidics chce zintensyfikować działania w projekcie PCR|ONE
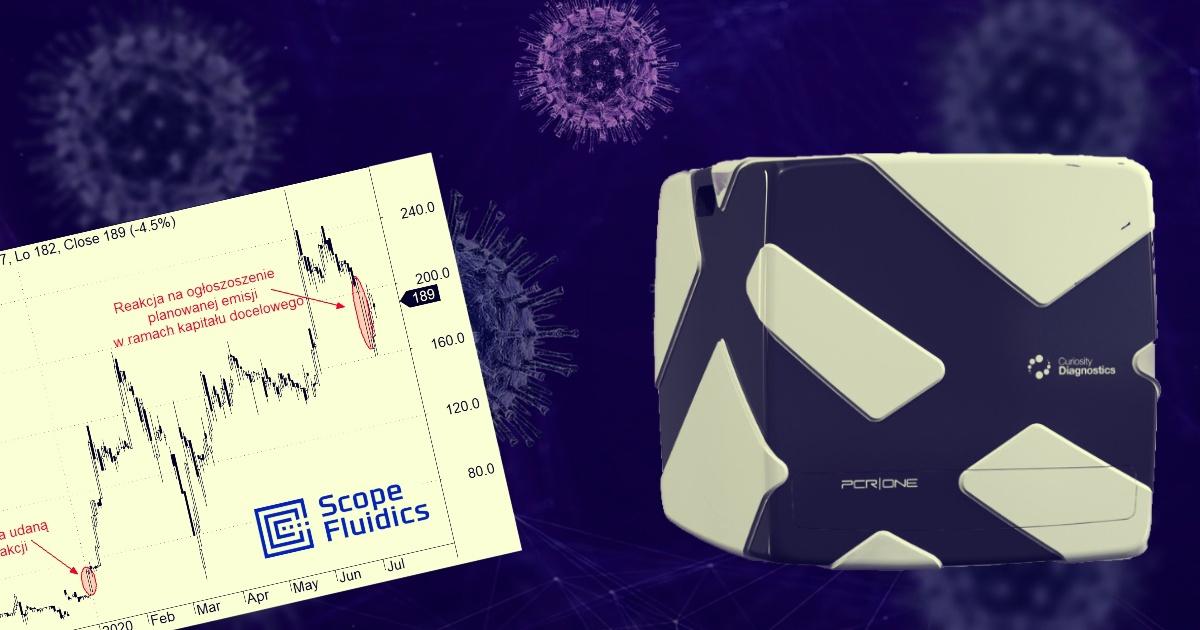
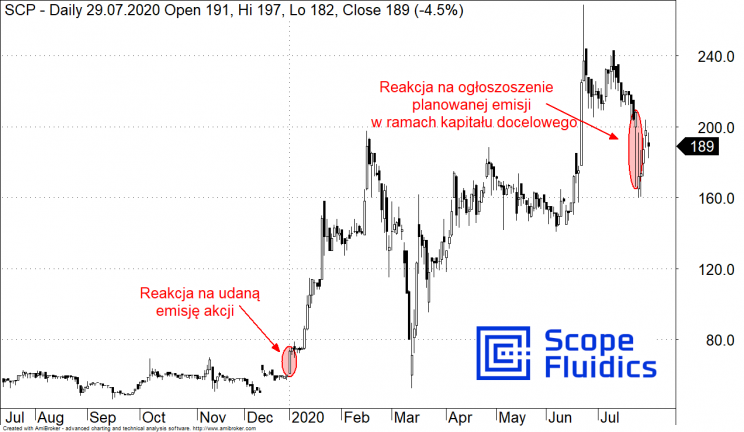
Kurs akcji Scope Fluidics
Epidemia stała się więc nie tylko szansą, ale i wyzwaniem dla spółki. Utrudnia bowiem prowadzenie badań klinicznych koniecznych do rejestracji PCR|ONE w szybkim badaniu gronkowca złocistego (MRSA/MSSA). Powód jest dość oczywisty - w obecnych warunkach mocno utrudniony jest dostęp do szpitali, gdzie prowadzone są badania kliniczne. Dlatego już kilka tygodni temu spółka zapowiedziała opóźnienie certyfikacji CE–IVD dla PCR|ONE o 3-4 miesiące. Odpowiadając na zapotrzebowanie rynku, Scope Fluidics opracowało już jednak panel badawczy dla SARS-CoV-2 i zamierza ubiegać się o jego certyfikację CE–IVD w Europie, jak również w FDA w ramach Emergency Use Submission.
Zobacz także: Scope Fluidics chce rozszerzyć możliwości diagnostyczne PCR|ONE w kierunku wykrywania koronawirusa – Covid19
Jakie działania są planowane w ramach rozwoju PCR|ONE w badaniu COVID-19?
Skutkiem epidemii koronawirusa jest skokowy wzrost rynku diagnostyki molekularnej Point-Of-Care. W 2020 roku odnotowano skokowy dynamika rynku wynosi 17%, nakładający się na wieloletni trend na poziomie 10% wzrostu rok do roku.
Scope Fluidics już zrealizowało panel do przeprowadzania w PCR|ONE testów na SARS-CoV-2. Spółka wyselekcjonowała 100 podmiotów zainteresowanych zakupem urządzenia i rozpoczęła wstępne rozmowy z 30 z nich. Obecnie ma podpisanych 10 umów o zachowaniu poufności NDA. Planowane przez spółkę działania stanowią odpowiedź na oczekiwania zgłaszane przez potencjalnych nabywców i mają za zadanie zwiększyć atrakcyjność komercyjną urządzenia.
Dlatego też Scope Fluidics przewiduje Early Access Program (EAP) dla PCR|ONE. Spółka chce udostępnić testowo urządzenie PCR|ONE do testów COVID-19 firmom farmaceutycznym, klinikom do testów użytkowych urządzenia i przeprowadzenie w ten sposób kilkudziesięciu tysięcy testów na koronawirusa. Tego rodzaju testy użytkowe potwierdzą jednoznacznie wartość urządzenia. Aby to osiągnąć, spółka musi wytworzyć około 100 urządzeń PCR|ONE oraz powiększyć moce produkcyjne tak, aby być w stanie wyprodukować około 50-100 tys. paneli do analizy SARS-CoV-2 oraz znaleźć podwykonawcę, który zobowiąże się do masowej produkcji paneli do analizy koronawirusa.
Urządzenie PCR|ONE do szybkiego testowania gronkowca złocistego i SARS-CoV-2
„Od kilku tygodni przygotowujemy się do rozpoczęcia produkcji analizatorów na szerszą skalę. Zwiększamy jednocześnie moce produkcyjne paneli” – deklaruje Piotr Garstecki.
Dostarczenie pakietu w postaci skutecznego urządzenia, przetestowanego użytkowo z przewidywalnymi kosztami produkcji, skalowalnym i odpowiednio niskim kosztem produkcji, ma stanowić odpowiednią wartość dla potencjalnych partnerów przy komercjalizacji. Scope Fluidics już pracuje nad certyfikacją dla FDA i zakłada dopuszczenie systemu PCR|ONE na rynek amerykański przez FDA w formule Emergency Use Authorisation w IV kwartale 2020.
Zobacz także: Emisja akcji w Scope Fluidics ma zwiększyć potencjał PCR|ONE. Oto jak będzie wyglądać transakcja krok po kroku
PCR|ONE po epidemii koronawirusa
Docelowo zaoferowane potencjalnym partnerom do komercjalizacji urządzenie PCR|ONE, po przeprowadzeniu dodatkowych inwestycji, ma szansę osiągnąć większą wartość niż przed epidemią. W przypadku powodzenia wszystkich przeprowadzonych działań urządzenie będzie oferować wykrywanie zarówno bakterii MRSA/MSSA jak również wirusów SARS-CoV-2, a w planach jest kilka innych paneli diagnostycznych. Docelowo wystawiony na sprzedaż PCR|ONE będzie pakietem zawierającym technologię i konkretną szacunkową wartość skalowalnej produkcji urządzenia oraz paneli do badania. Ma posiadać certyfikat CE–IVD w Europie na badanie MRSA/MSSA i SARS-CoV-2 oraz dopuszczenie na największy rynek świata przez FDA w badaniu SARS-CoV-2 w ramach Emergency Use Authorisation.